Introduzione
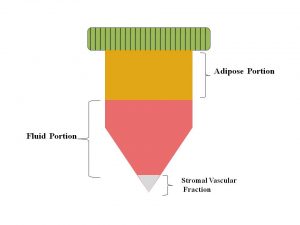
L’idea di utilizzare il grasso come materiale di riempimento non è recente, infatti il primo utilizzo di innesti di grasso autologo è stata presentata da Neuber nel 1893 per il trattamento di difetti facciali (1). Nel 1910, Lexer ha per la prima volta utilizzato la tecnica in chirurgia plastica per aumentare le regioni malari e come riempitivo (2). Mentre, nel 1911, Bruning è stato il primo ad iniettare il grasso autologo nel tessuto sottocutaneo al fine di aumentare i tessuti molli (3). Solo nel 1950 fu pubblicato il primo articolo che descriveva il comportamento del tessuto adiposo autologo infiltrato per la correzione del profilo corporeo (4), dimostrando che il tasso di sopravvivenza per i trapianti di grasso autologo potrebbe essere più elevato del 50%.Il tessuto adiposo è composto principalmente da cellule adipose organizzate in lobuli (5-6). Si tratta di un tessuto altamente complesso costituito da adipociti maturi, che costituiscono più del 90% del tessuto e una frazione stromale vascolare (SVF), che comprende, preadipociti, fibroblasti, muscolatura liscia vascolare, cellule endoteliali, monociti/macrofagi residenti, linfociti e ASCs (7).
Definizione di Stromal Vascular Fraction (SVF)
All’interno del tessuto adiposo vi è una popolazione di cellule speciali note come frazione stromale vascolare, che consiste di cellule staminali, nonché di cellule immunitarie, endoteliali (rivestimento dei vasi sanguigni), progenitrici (cellule precursore indifferenziate o premature) e stromali (tessuto connettivo). Le cellule della frazione stromale vascolare hanno proprietà simili a quelle del midollo osseo. Entrambe contengono una popolazione di cellule che ha la capacità di differenziarsi in diversi tipi di cellule. Inoltre, sia il tessuto adiposo che il midollo osseo offrono ambienti simili per la crescita e la riproduzione ottimale delle cellule staminali, incluse una minore quantità di ossigeno circolante e sistemi vascolari specializzati rispetto ad altri organi.
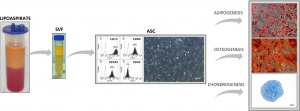
Molti autori hanno selezionato e caratterizzato celle staminali dalla frazione vascolare stromale (SVF) del tessuto adiposo ed hanno analizzato la loro capacità differenziativa (8-9). All’interno della SVF, sono state isolate differenti popolazioni cellulari che esprimono i markers delle staminali mesenchimali quali CD34, CD90, CD29, CD44, CD105, CD117 e markers di cellule progenitrici endoteliali che esprimono CD34, CD90, CD44, CD54 (10). Tali cellule differenziano, in vitro, in determinate condizioni colturali, in adipociti (11); inoltre sono capaci di differenziare in cellule endoteliali (CD31+/VEGF+/Flk-1+) (12) mentre su appropriati scaffold, sono capaci di formare differenti tipi tissutali (13-16).
Cellule staminali adipose (ASCs)
Le ASCs possono essere isolate dalla SVF mediante coltura in vitro. Tali cellule crescono in forma fibroblast-like e sono caratterizzate dal possedere queste caratteristiche: 1) self-renewal ovvero auto-rinnovamento; 2) alta capacità proliferativa; 3) capacità differenziativa in diverse linee cellulari come adiposa, osteogenica, condrogenica, ma anche neurogenica, epiteliale, muscolari. Tali cellule possono essere isolate mediante l’analisi di alcuni marcatori di superficie come ad esempio la doppia positività per CD34 e CD90 (markers di natura mesenchimale).
Standardizzazione e regolarizzazione delle cellule staminali adipose
Dato la presenza di numerosi lavori scientifici riguardo la SVF e le ASCs contenute al suo interno, la “International Federation for Adipose Therapeutics and Science” (IFATS) (10) insieme alla “International Society for Cellular Therapy” (ISCT) (17) hanno emanato le linee guida per standardizzare e riassumere tutti i dati e le ricerche pubblicate nella letteratura scientifica ed il loro rapporto con gli studi clinici. In accordo con tale dichiarazione, le cellule dovrebbero avere una vitalità maggiore del 70% per la SVF e maggiore del 90% per le ASCs. La frequenza di progenitori staminali analizzati con la CFU-F (fibroblast colony forming unit assay) è previsto essere maggiore del 1% per SVF e maggiore del 5% per ASCs. Per quanto riguarda l’identità cellulare della SVF, l’immunofenotipo dovrebbe avere queste caratteristiche: positività per CD13, CD29, CD44, CD73, CD90 (maggiore del 40%), e CD34 (maggiore del 20%) ma negativo per CD31 e per CD45. Invece, l’immunofenotipo delle ASCs dovrebbe avere la positività per CD13, Cd29, CD44, CD73, CD90 e CD105 (maggiore del 80%) e negatività per CD31, CD45 e CD232a.
Isolamento enzimatico della SVF
La più comune tecnica di isolamento e purificazione del tessuto adiposo per ottenere la SVF è la cosiddetta “digestione enzimatica”. In generale, vengono usati enzimi come la collagenasi, la tripsina e la dispasi. Sebbene, le tecniche sono diverse, tutte seguono una procedura standard. Le differenze si trovano principalmente nel numero di steps riguardanti il lavaggio, la concentrazione enzimatica, i diversi parametri di centrifugazione, i metodi di lisi degli eritrociti, così come la filtrazione e le eventuali condizioni di coltura.
In breve, il tessuto adiposo viene lavato, trattato mediante digestione enzimatica e le cellule vengono separate dai materiali di scarto (oli, radicali liberi, sangue, enzimi) mediante la centrifugazione. Le concentrazioni di enzima variano tra i diversi produttori ma sono di solito indicati in volume percentuale (w/v) e variano da 0,075% (w/v) fino a 0,3% (w/v).
I principali sistemi commerciali che utilizzano questo sistema comprendono l’AdiStem (AdiStem Pty Ld, China), Sepax (Biosafe Group SA, Switzerland), Celution (Cytori Therapeutics Inc, Usa). Questi sono i più importanti ma ve ne sono molti altri. Tutti questi sistemi sono stati testati e mostrano una reale efficacia. Ad esempio, con AdiStem è possibile isolare un numero di cellule vitali di 12×106 ml di grasso rispetto ai metodi di isolamento standard. Oppure il sistema Celution (quello di gran lunga più famoso) presenta una redditivitò del 86,6% ed è stato ampiamente utilizzato in varie patologie (18).
Sicurezza dell’isolamento enzimatico
Oltre agli elevati costi, ma soprattutto per la citotossicità riscontrata (19) come ad esempio il rischio di sviluppo di encefalite spongiforme (20) e per la comparabile efficacia rispetto ad altri sistemi non enzimatici (21) questi metodi sono stati progressivamente abbandonati.
Isolamento non enzimatico della SVF
I metodi d’isolamento non enzimatici si basano sulla forza di centrifugazione, pressione, filtrazione e lavaggio. Tutti questi meccanismi sostituiscono la digestione enzimatica per separare le cellule o gli aggregati cellulari dal tessuto adiposo. In particolare, alcuni sistemi hanno dimostrato che il lavaggio e la filtrazione garantiscono una maggiore vitalità cellulare ed una minore presenza di globuli rossi, lipidi liberi e contaminanti.
In commercio, esistono diversi sistemi di isolamento cellulare che generano un tessuto adiposo arricchito di SVF. Tra questi, abbiamo i dispositivi per la raccolta e l’omogeneizzazione del tessuto adiposo e comprendono il Puregraft (Bimini Technologies LLC, Usa), Fastkit (Fastem) (Corios Soc. Coop, Italy), LipiVage (Genesis Biosystems, Inc, Usa), Lipogems (Lipogems International SPA, Italy), Lipo-Kit GT (Medikan International Inc, USA). Numerosi altri sistemi, invece, mirano alla separazione delle cellule staminali adulte dal tessuto adiposo come il sistema Wal Body-Jet e il sistema Q-graft (Human Med AG, Germany), alla estrazione della SVF mediante cavitazione ad ultrasuoni come IntelliCell (Biosciences Inc, USA).
– Il sistema PureGraft stabilisce un nuovo standard per il trattamento dell’innesto di grasso grazie alla sua filtrazione del tessuto attraverso una particolare membrana. La tecnologia PureGraft richiede solo 15 minuti per purificare un innesto di grasso da 50 a 250 ml , rimuovendo in modo controllabile liquidi in eccesso e indesiderati, lipidi, cellule del sangue e residui. Il sistema monouso, utilizzato in campo sterile, “dializza” tutto tranne il tessuto di grasso purificato senza ricorrere alla centrifugazione o ad altri metodi. Il sistema di lavaggio e filtrazione del tessuto adiposo con Puregraft ha mostrato una buona vitalità tissutale ed una scarsa presenza di globuli rossi, lipidi liberi e contaminanti rispetto ai metodi standardi di centrifugazione e/o decantazione (22,23).
– Il sistema di raccolta, lavaggio e trasferimento LipiVage è un dispositivo che permette di raccogliere gli innesti adiposi in condizioni controllate a basso vuoto evitando la centrifugazione, decantazione od altri passaggi. Tale sistema si collega direttamente alla pompa di aspirazione. Una volta all’interno della cannula, il grasso viene separato da oli e fluidi da un filtro integrato. Tale sistema ha mostrato la presenza di cellule staminali mesenchimali e progenitori che mantenevano la loro capacità differenziativa (24) e quando veniva applicato attraverso un sistema spray (fibrin spray), questo produceva una maggior numero di adipociti vitali (25)
– Il sistema LIPOGEMS è un kit monouso per la lipoaspirazione, preparazione ed innesto di tessuto adiposo prelevato dallo stesso paziente. L’intera procedura avviene in un unico tempo, sterilmente ed a livello ambulatoriale. Il prodotto ottenuto con la tecnica LIPOGEMS è tessuto adiposo ridotto in piccoli frammenti che sono progressivamente ridotti di dimensioni e purificati dai residui oleosi ed ematici. Il prodotto ottenuto con la tecnica LIPOGEMS conserva le caratteristiche biologiche del tessuto connettivo adiposo naturale, ma, grazie alle ridotte dimensioni può essere iniettato attraverso aghi sottili con minimo traumatismo. LIPOGEMS, essendo tessuto adiposo autologo in forma fluida, oltre al suo ruolo nella rigenerazione tissutale grazie all’elevato contenuto in cellule mesenchimali, è da considerarsi un filler. L’intera procedura è condotta a livello ambulatoriale ed in anestesia locale. Si aspirano circa 60cc di tessuto adiposo dal grasso comunemente presente a livello dell’addome o della coscia; si procede a questo punto alla preparazione del grasso aspirato ed alla sua iniezione. Le cellule Le cellule isolate mediante il Lipogems presentano una maggiore percentuale di periciti e ASCs ed una minore quantità di cellule ematopoietiche rispetto ai sistemi enzimatici (26,27).
– Il sistema Fastem (Corios) prevede una prima fase di filtrazione automatica in un’apposita borsa, cicli di centrifugazione a 1700 giri per 10 minuti e la sospensione così ottenuta viene infine filtrata attraverso un filtro da 0,2 micrometri. Successivamente questa sospensione viene mescolata con l’innesto di grasso ed utilizzata. Tale sistema inizialmente ha prodotto un grande interesse in quanto si ipotizzava che quasi tutte le cellule di tessuto adiposo adulto iniettate muoiono e sono sostituite dalla differenziazione di cellule staminali mesenchimali contenute nella sospensione. Tale lipofilling arricchito in ASCs presenta un adeguato rapporto di cellule adipose e cellule staminali. Sulla bse di diversi studi prodotti, si è evidenziato che tale tecnica non risulta efficace nella produzione delle cellule staminali adipose rispetto alle altre menzionate (26,28).
Nuovi sistemi di isolamento della SVF
Negli ultimi anni, stanno prendendo piede due diversi sistemi di purificazione del grasso e di arricchimento che non si basano sui metodi in precedenza affermati. Il primo è rappresentato dal sistema “Body Jet” (Human Med) che utilizza una particolare forma di lipoaspirazione assistita con un getto d’acqua che è in grado di provocare un’idro-dissezione in cui le cellule adipose si disimpegnano in modo dolce dalla struttura lobulare del tessuto. In particolare, questa è una procedura di liposuzione che utilizza la soluzione tumescente come un getto pulsato e sottile ad una frequenza specifica ed a forma di ventaglio. La cannula utilizzata comprende 2 canali che rendono possibile sia l’infiltrazione della soluzione tumescente a ventaglio sia aspirare contemporaneamente i fluidi infiltrati e la sospensione adiposa. In tale maniera la quantità di fluidi infiltrata nel paziente è molto più bassa rispetto alle procedure convenzionali. I piccoli cluster di cellule adipose sono selettivamente “lavati” ed “aspirati” allo stesso tempo in un sistema sterile chiuso. In questa maniera il tessuto adiposo aspirato e il fluido d’irrigazione sono separati in condizioni di vuoto che rende superflua la necessità di centrifugazione o qualsiasi altro trattamento aggiuntivo del grasso prima del suo trasferimento, quindi con una riduzione notevole del traumatismo che riduce notevolmente la sopravvivenza delle cellule adipose così come l’uso di micro-cluster adiposi rende ragione della maggiore tollerabilità e sopravvivenza in quando si adatta meglio al micro-circolo vascolare dell’ambiente ricevente favorendone l’attecchimento (29). I risultati ottenuti da diversi autori hanno dimostrato una notevole affidabilità di differenziazione delle cellule staminali isolate mediante il body jet (30,31).
La medesima azienda ha prodotto un nuovo sistema, di cui non abbiamo ancora nessun riscontro bibliografico sulla letteratura internazionale. Tale sistema prende il nome di Q-graft è rappresenta essere un separatore intra-operatorio del tessuto adiposo per la selezione della SVF. Tale sistema prevede un’incubazione a 38°C per 45 minuti del tessuto adiposo prelevato con la metodica body jet ed una successiva filtrazione per ottenere la SVF.
Per semplificare e migliorare ulteriormente questo meccanismo, alcuni autori hanno ideato un sistema “puro” di disgregazione meccanica (33,34) del tessuto molto più facile da usare, meno costoso e più rapido. Il protocollo “Rigenera” è costituito da quattro fasi: 1) prelievo del tessuto; 2) disgregazione del tessuto nel “rigeneracons” con l’aggiunta di 1ml di soluzione fisiologica (od anche PRP autologo); 3) raccolta dei microinnesti ottenuti dopo la disgregazione meccanica ad opera del rigeneracons; 4) l’iniezione dei microinnesti nel sito della lesione o in combinazione con appositi scaffold. E’ stato dimostrato che il tessuto adiposo lipoaspirato umano microframmentato non modifica assolutamente il contenuto delle strutture stromali così come delle cellule ma riesce ad attivare una serie di cambiamenti molecolari che aumentano le proprietà rigenerative naturali del tessuto ricevente. La principale unità strutturale e morfologica, la nicchia adiposa, viene mantenuta dopo la disgregazione e protegge le ASCs attivate, rafforzando la loro efficacia nell’ambiente ricevente. Questa è la principale differenza tra questo sistema e gli altri, perché la conservazione delle nicchie strutturali adipose aumenta l’efficacia delle ASCs. Inoltre, l’eliminazione della centrifugazione e il trattamento enzimatico minimizza i traumi dei tessuti preservando l’integrità cellulare. Così come la riduzione della dimensione dei cluster adiposi favorisce il suo attecchimento a causa di una rivascolarizzazione del microinnesto più facile, efficace e veloce grazie alla sua interazione con il microambiente vascolare ricevente.
Conclusioni
Negli ultimi dieci anni il tessuto adiposo sottocutaneo è diventato l’argomento principale della chirurgia plastica e della medicina rigenerativa. Le SVF così come le ASCs sono state, con successo, utilizzate in studi e trials clinici. Nonostante ciò, ci sono ancora degli inconvenienti associati alle diverse strategie terapeutiche e soprattutto ai diversi regolamenti in uso nei vari paesi europei ed extra-europei. In particolar modo, alcuni paesi, soprattutto extra-europei, continuano ad utilizzare la collagenasi. Per tale motivo la IFATS sta ideando un protocollo operativo standard comune senza l’utilizzo di tossine e xenofree. Di conseguenza, l’attenzione si sta sempre più rivolgendo ai sistemi chiusi non enzimatici giacché rappresentano il mezzo più sicuro ed efficace per la purificazione del tessuto adiposo. Ovviamente ogni sistema o metodo o protocollo ha diversi vantaggi e svantaggi. Pertanto è fondamentale il continuo sviluppo ed ottimizzazione soprattutto ai fini di particolari parametri come il lavaggio, il sistema di filtrazione, l’eventuale centrifugazione, le dimensioni delle cannule. Tutti questi parametri dovranno essere attentamente studiati e comparati al fine di produrre dei sistemi che possano rendere quanto più efficiente l’uso delle “terapie cellulari”.
Ad oggi nessun sistema sembra raggiungere le caratteristiche ideali per soddisfare quei requisiti stabiliti dalla “International Federation for Adipose Therapeutics and Science” (IFATS) (10) insieme alla “International Society for Cellular Therapy” (ISCT) e pertanto possiamo solo fare delle “ipotesi” di efficacia di un sistema rispetto ad un altro oppure di un insieme di diversi sistemi che possono complementarsi tra di loro.
Francesco De Francesco
REFERENZE
- Neuber G. Fat trasplantation. Verl Dtsch Ges Chir 1893; 22:66 Long Vern
- Lexer E. Freie fettransplantation. Dtsch Med Wochenschr 1910; 36:640
- Brunning P, Broeckaert TJ. Contribution a l’etude desgreffes adipeueses. Bull Acad Roy Med Belgique. 1914; 28:440.
- Peer LA. Loss of weight and volume in human fat grafts with postulation of “cell survival theory”. Plast Reconstr Surg. 1950; 5:217
- Cinti S. The adipose organ. Prostaglandins Leukot Essent Fatty Acids. 2005; 73:9-15
- Cinti S. Between brown and white: novel aspect of adipocyte differentiation. Ann Med. 2011; 43:104-15
- De Francesco F, Ricci G, D’Andrea F, Nicoletti Gf, Ferraro GA. Human adipose stem cells: from bench to bedside. Tissue Eng Part B Rev. 2015; 21:572-84.
- Nguyen A, Guo J, Banyard DA, Fadavi D, Toranto JD, Wirth GA, Paydar KZ, Evans GR, Widgerow AD. Stromal vascular fraction: a regenerative reality? Part 1: current concepts and review of the literature. J Plast Reconstr Aesthet Surg. 2016; 69:170-9
- Guo J, Nguyen A, Banyard DA, Fadavi D, Toranto JD, Wirth GA, Paydar KZ, Evans GR, Widgerow AD. Stromal vascular fraction: a regenerative reality? Part 2: mechanisms of regenerative action. J Plast Reconstr Aesthet Surg. 2016; 69:180-8
- Bourin, P., Bunnell, B.A., Casteilla, L., Dominici, M., Katz, A.J., March, K.L., Redl, H., Rubin, J.P., Yoshimura, K., Gimble, J.M. Stromal cells from the adipose tissue-derived stromal vascular fraction and culture expanded adipose tissue-derived stromal/stem cells: a joint statement of the International Federation for Adipose Therapeutics and Science (IFATS) and the International Society for Cellular Therapy (ISCT). Cytotherapy 15, 641, 2013.
- D’Andrea, F., De Francesco, F., Ferraro, G.A., Desiderio, V., Tirino, V., De Rosa, A., Papaccio, G. Large-scale production of human adipose tissue from stem cells: a new tool for regenerative medicine and tissue banking. Tissue Eng Part C Methods 14, 233, 2008.
- De Francesco, F., Tirino, V., Desiderio, V., Ferraro, G., D’Andrea, F., Giuliano, M., Libondi, G., Pirozzi, G., De Rosa, A., Papaccio, G. Human CD34/CD90 ASCs are capable of growing as sphere clusters, producing high levels of VEGF and forming capillaries. PLoS One 6, e6537, 2009.
- Ferraro, G.A., De Francesco, F., Nicoletti, G., Paino, F., Desiderio, V., Tirino, V., D’Andrea, F. Human adipose CD34+CD90+ stem cells and collagen scaffold constructs grafted in vivo fabricate loose connective and adipose tissues. J Cell Biochem 114, 1039, 2013.
- Desiderio, V., De Francesco, F., Schiraldi, C., De Rosa, A., La Gatta, A., Paino, F., d’Aquino, R., Ferraro, G.A., Tirino, V., Papaccio, G. Human Ng2+ adipose stem cells loaded in vivo on a new crosslinked hyaluronic acid-Lys scaffold fabricate a skeletal muscle tissue. J Cell Physiol 228, 1762, 2013.
- Altman, A.M., Yan, Y., Matthias, N., Bai, X., Rios, C., Mathur, A.B., Song, Y.H., Alt, E.U. IFATS collection: Human adipose-derived stem cells seeded on a silk fibroin-chitosan scaffold enhance wound repair in a murine soft tissue injury model. Stem Cells 27, 250, 2009.
- Hemmrich, K., Van de Sijpe, K., Rhodes, N.P., Hunt, J.A., Di Bartolo, C., Pallua, N., Blondeel, P., von Heimburg, D. Autologous in vivo adipose tissue engineering in hyaluronan-based gels—a pilot study. J Surg Res 144, 82, 2008.
- Dominici M, Le Blanc K, Mueller I, Slaper-Cortenbach I, Marini F, Krause D, Deans R, Keating A, Prockop Dj, Horwitz E. Minimal criteria for defining multipotent mesenchymal stromal cells. The International Society for Cellular Therapy position statement. Cytotherapy. 8:315-7. 2006.
- Lin K, Matsubara Y, Masuda Y, Togashi K, Ohno T, Tamura T, Toyoshima Y, Sugimachi K, Toyoda M, Marc H, Douglas A. Characterization of adipose tissue-derived cells isolated with the Celution system. 2008;10:417–26.
- Carvalho PP, Gimble JM, Dias IR, Gomes ME, Reis RL. Xenofree enzymatic products for the isolation of human adipose-derived stromal/stem cells. Tissue Eng Part C Meth. 2013;19(6):473–8.
- International Society for Cellular Therapy. Risk of bovine spongiform encephalopathy (BSE) in collagenase enzymes. 2007. Available at: www.celltherapysociety.org/files/PDF/Resources/Risk_BSE_in_Collagenase_Enzymes.pdf. Accessed April 2, 2012
- Kirkpatrick CJ, Melzner I, Goller T. Comparative effects of trypsin, collagenase and mechanical harvesting on cell membrane lipids studied in monolayer cultured endothelial cells and a green monkey kidney cell line. Biochim Biophys Acta. 1985;846(1):120–6.
- Mestak O, Sukop A, Hsueh YS, Molitor M, Mestak J, Matejovska J, Zarubova L. Centrifugation versus Puregraft for fatgrafting to the breast after breast-conserving therapy. World J Surg Oncol. 12:128, 2014.
- Zhu M, Cohen SR, Hicok KC, Shanahan RK, Strem BM, Yu JC, Arm DM, Fraser JK. Comparison of three different fat graft preparation methods: gravity separation, centrifugation, and simultaneous washing with filtration in a closed system. Plast Reconstr Surg. 2013;131:873–80.
- Ferguson REH, Cui X, Fink BF, Vasconez HC, Pu LLQ. The viability of autologous fat grafts harvested with the lipivage system. Ann Plast Surg. 60:594-597. 2008.
- Zimmerlin L, Rubin JP, Pfeifer ME, Moore LR, Donnenberg VS, Donnenberg AD. Human adipose stromal vascular cell delivery in a fibrin spray. Cytotherapy. 2013;15(1):102–8. doi:10.1016/j.jcyt.2012.10.009.
- Domenis R, Lazzaro L, Calabrese S, Mangoni D, Gallelli A, Bourkoula E, Manini I, Bergamin N, Toffoletto B, Beltrami CA, Beltrami AP, Cesselli D, Parodi PC. Adipose tissue derived stem cells: in vitro and in vivo analysis of a standard and three commercially available cell-assisted lipotransfer techniques. Stem Cell Res and Ther. 2015; 6:2
- Carelli S, Messaggio F, Canazza A, Hebda DM, Caremoli F, Latorre E, Grimoldi MG, Colli M, Bulfamante G, Tremolada C, Di Giulio AM, Gorio A. Characteristics and properties of mesenchymal stem cells derived from microfragmented adipose tissue. Cell Transplant 2015; 24:1233-52;
- Gentile P, Scioli MG, Orlandi A, Cervelli V. Breast reconstruction with enhanced stromal vascular fraction fat grafting: what is the best method? Plast Reconstrs Surg Glob Open 2015; 3:e406.
- Purpura V, Bondioli E, Melandri D, Parodi PC, Vaienti L, Riccio M. The collection of adipose derived stem cells using water-jet assisted lipoplasty for their use in plastic and reconstructive surgery: a preliminary study. Front Cell Dev Biol. 2016; 4:136.
- Meyer J, Salamon A, Herzmann N, Adam S, Kleine HD, Matthiesen I, Ueberreiter K, Peters K. Isolation and differentiation potential of human mesenchymal stem cells from adipose tissue harvested by water-jet assisted liposuction. Aesthet Surg J. 2015; 35:1030-9.
- Yin S, Luan J, Fu S, Wang Q, Zhuang Q. Does water-jet force make a difference in fat grafting? In vitro and in vivo evidence of improved lipoaspirate viability and fat graft survival. Plastic Reconstr Surg 135:127, 2015.
- Oberbauer E, Steffenhagen C, Wurzer C, Gabriel C, Redl H, Wolbank S. Enzymatic and non-enzymati isolation systems for adipose tissue-derived cells: current state of the art. Cell Regen. 2015; 4:7
- Trovato L, Monti M, Del Fante C, Cervio M, Lampinen M, Ambrosio L, Redi CA, Perotti C, Kankuri E, Ambrosio G, Rodriguez Y Baena R, Pirozzi G, Graziano A. A New medical device rigeneracons allows to obtain viable micrografts from mechanical disaggregation of human tissues. J Cell Physiol 2015; 230:2299-303
- Purpura V, Bondioli E, Graziano A, Trovato L, Melandri D, Ghetti M, Marchesini A, Cusella De Angelis MG, Benedetti L, Ceccarelli G, Riccio M. Tissue Characterization after a new disaggregation method for skin micro-grafts generation. J Vis Exp 2016; 4:e53579.
